Eles são partículas tão pequenas que é impossível enxergá-los a olho nu e nem mesmo usando um microscópio com altíssimas resoluções.
Se colocarmos 1 milhão de átomos alinhados, isso não chegaria nem a espessura de um pelo de um gatinho
Agora imagine uma praia, existe muita areia nele, não é mesmo? Mas se analisarmos um único grão de areia, ele terá mais átomos do que folhas nas copas de todas as árvores adultas.\
Estrutura do átomo
Os átomos possuem sempre o mesmo formato. Eles são compostos por um núcleo central que é composto por partículas de carga positiva, chamadas de prótons, e, por partículas de cargas neutras, chamadas de nêutrons.
Em volta do núcleo, ficam as partículas de carga negativa, chamadas de elétrons. Os elétrons giram em torno do núcleo em orbitas com trajetórias distintas umas das outras.
O número de partículas é o que torna um átomo diferente do outro. Atualmente são conhecidos 118 átomos diferentes que combinados formam os elementos químicos da tabela periódica.
A maioria desses átomos é natural, mas alguns foram criados em laboratórios.
Modelos atômicos
Como os átomos são muito pequenos, os cientistas criaram representações estruturais para que pudéssemos entender como é um átomo.
Modelo de Dalton
Muitos modelos já foram criados ao longo dos séculos, o primeiro foi em 1808 o inglês John Dalton propôs um modelo chamado “bola de bilhar” com os seguintes princípios:
- Todas as substâncias são formadas por pequenas partículas chamadas átomos;
- Átomos de um mesmo elemento são iguais;s
- Átomos não se alteram quando formam componentes químicos;
- Átomos não podem ser criados, nem destruídos. Eles são permanentes e indivisíveis.
- Reações químicas acontecem quando os átomos estão se reorganizando.

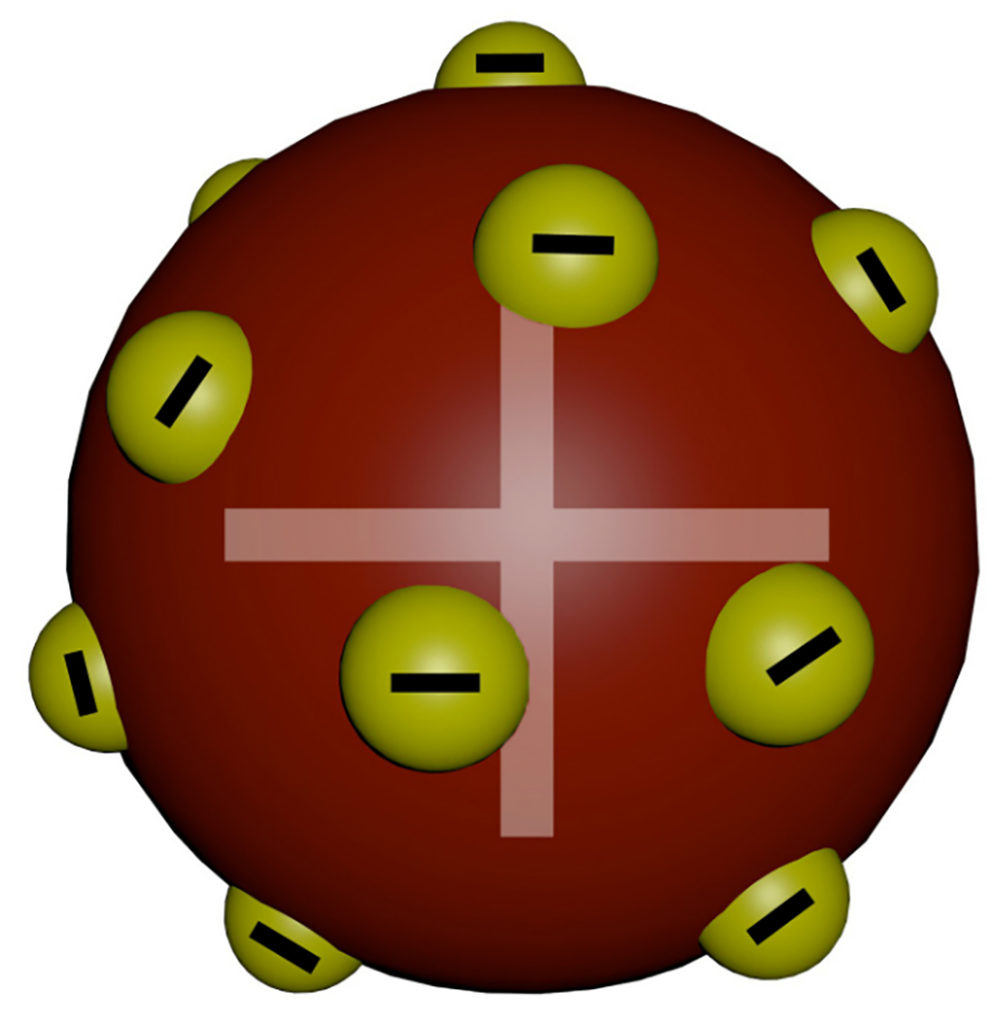
Modelo de Thomson
Em 1887, o físico inglês Thomson reorganizou o modelo atômico de Dalton e criou o modelo chamado “pudim de ameixa” e ficou conhecido como “pai do elétron”. Para ele o modelo seguia as premissas:
- Átomos eram os constituintes universais da matéria;
- Átomos são divisíveis;
- Os átomos possuíam feixes de cargas negativas chamadas de raios catódicos;
- Átomos tinham cargas elétricas negativas e positivas distribuídas igualmente;
- Átomos eram constituintes de todas as matérias existentes.
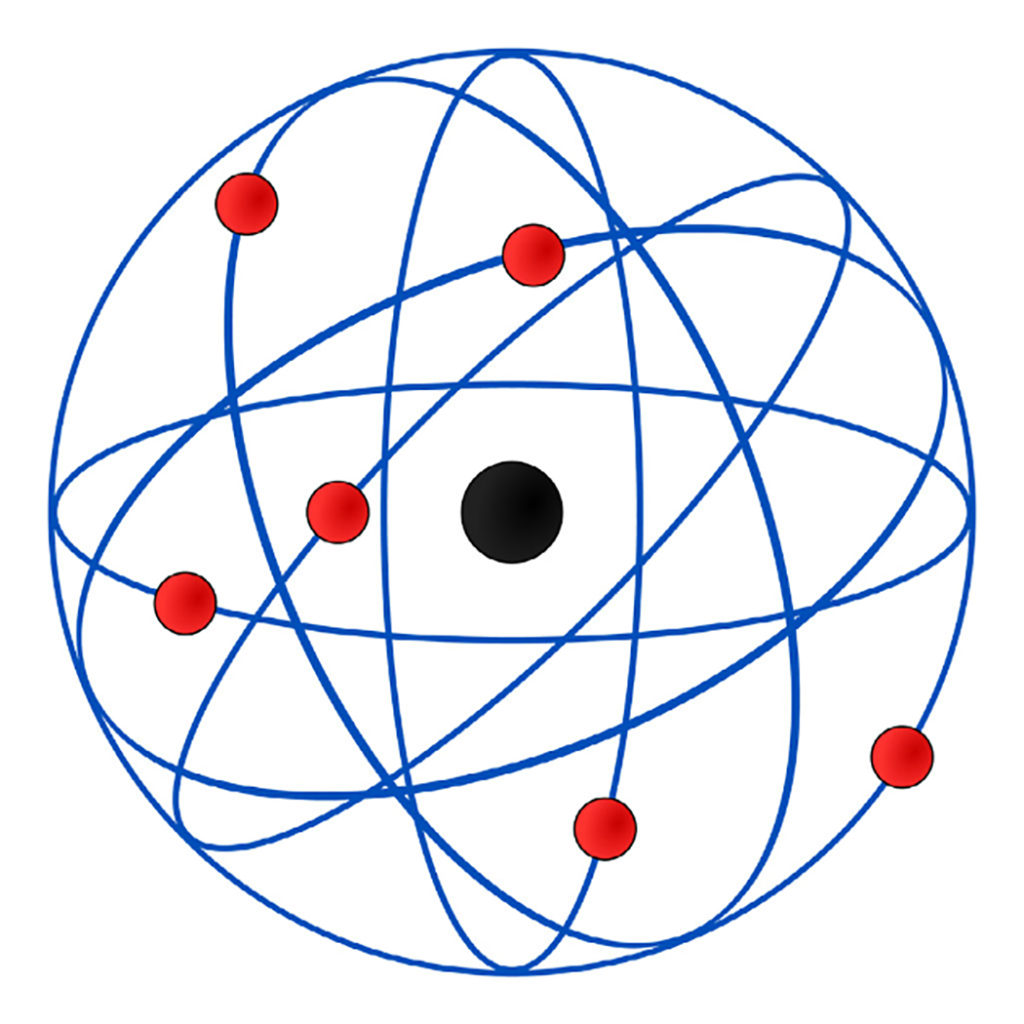
Modelo de Rutherford
Em 1911, um físico neozelandês chamado Rutherford criou o modelo chamado planetário. Ele realizou um ensaio com uma folha de ouro dentro de uma câmera metálica.
Ele observou que algumas partículas não se movimentavam, algumas não eram afetadas e a maioria atravessava livremente a folha de ouro.
Nesse modelo tinham as seguintes premissas:
- As partículas dos átomos tinham força de repulsão elétrica;
- O átomo possui núcleo que era composto por uma maioria de cargas positivas;
- Elétrons se movem em órbitas circulares em volta do núcleo.
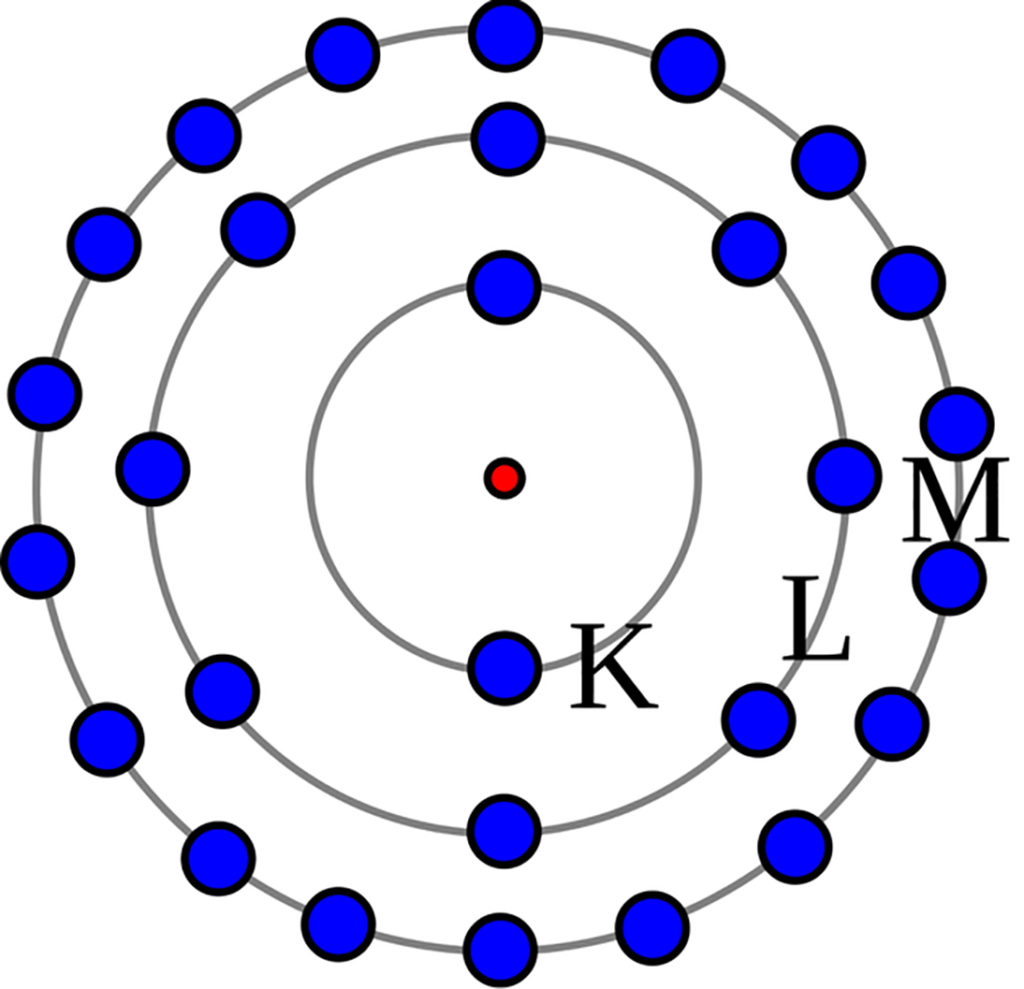
Modelo de Bohr ou Rutherford-Bohr
O físico dinamarquês Niels Bohr reformulou a teoria de Rutherford e acrescentou algumas concepções, criando o modelo de Bohr ou, também chamado de Rutherford-Bohr.
Esse é o modelo aceito pela comunidade científica atual e segue as seguintes premissas:
- Os elétrons giram ao redor do núcleo em orbitas determinadas, esse movimento é incrivelmente rápido;
- O átomo é extremamente pequeno, no entanto, maior parte de sua estrutura é vazia;
- Quando um átomo recebe uma carga elétrica, um elétron pula para a orbita maior e depois retorna a sua origem;
- Esse movimento de elétrons resulta em emissão de luz.
- Bohr sugeriu que os comprimentos de onda poderiam ser previstos a partir da constituição de átomos e movimentação dos elétrons.
Veja também:
